Dioxyde de xénon
Le dioxyde de xénon est le composé chimique de formule XeO2. Il fut synthétisé en 2011 par hydrolyse à 0 °C de tétrafluorure de xénon XeF4 avec 2,00 mol·L-1 d'acide sulfurique H2SO4[2].
| Dioxyde de xénon | |
| |
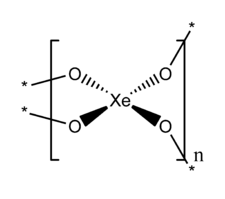
| Structure du dioxyde de xénon | |
| Identification | |
|---|---|
| Apparence | solide jaune |
| Propriétés chimiques | |
| Formule | XeO2 |
| Masse molaire[1] | 163,292 ± 0,007 g/mol O 19,6 %, Xe 80,4 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Structure
XeO2 a une structure étendue dans laquelle le xénon et l'oxygène sont respectivement de coordinence 4 et 2.
Propriétés
XeO2 est un solide jaune-orangé[3]. C'est un composé instable, avec une demi-vie d'environ deux minutes, qui se dismute en trioxyde de xénon XeO3 et en xénon Xe. Ses propriétés ont été étudiées en le refroidissant à −78 °C et c'est surtout la spectroscopie Raman qui a été utilisée[4].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David S. Brock et Gary J. Schrobilgen, « Synthesis of the Missing Oxide of Xenon, XeO2, and Its Implications for Earth’s Missing Xenon », Journal of the American Chemical Society, vol. 133, no 16, , p. 6265-6269 (PMID 21341650, DOI 10.1021/ja110618g, lire en ligne)
- (en) Simon Cotton, « Soundbite Molecules », sur Royal Society of Chemistry, (consulté le )
- (en) « Xenon Dioxide May Solve One of Earth's Mysteries », sur L’Actualité chimique canadienne (Canadian Chemical News)., (version du sur Internet Archive)
Cet article est issu de Wikipedia. Le texte est sous licence Creative Commons – Attribution – Partage à l’identique. Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.